1. Introduction
치료 영역 별 연구 데이터의 표준화는 규제기관의 데이터의 처리 속도를 높여, 신약 출시를 앞당겨 줍니다. FDA의 의약품 평가 연구센터 (Center for Drug Evaluation and Research, CDER)와 생물의약품 평가 연구센터(Center for Biologics Evaluation and Research, CBER)는 표준화의 중요성을 인지하고 2011년부터 질환 및 치료 영역의 우선순위를 두어 TAUG(Therapeutic Area Use Guide) 개발 및 사용을 지원하고 있으며, 이용가능한 TAUG 목록을 FDA 웹사이트에 업데이트 하고 있습니다. TAUG 우선 순위에 고려된 항목은 다음과 같습니다
- INDs (Investigational New Drug applications)의 개수 및 유형
- 표준화가 진행중인 치료 영역(Therapeutic Area)
- 신약 개발 관련 업계의 의견 등
TAUG 는 치료 영역 별 연구들의 수행 변동성을 줄이고, 임상 데이터의 표준화 및 제출에 활용될 수 있습니다.
2. TAUGs (Therapeutic Area User Guides)
CDISC*(Clinical Data Interchange Standards Consortium) 와 C-Path**(Clinical Path)는 협력하여 TAUG(Therapeutic Area User Guides)를 개발하고 있고, FDA는 권위있는 임상 및 의료 전문가 집단을 투입하여 이를 지원하고 있습니다. FDA의 검토 및 평가가 완료된 TAUGs는 STUDY DATA TECHNICAL CONFORMANCE GUIDE에 목록화 되어 사용이 권고되고 있으며, PMDA submission 에도 활용될 수 있습니다.

FDA에서 발간된 STUDY DATA THCHNICAL CONFORMANCE GUIDE(July 2020)에 TAUGs 목록은 다음과 같습니다.
- Dyslipidemia Therapeutic Area User Guide v1
- Chronic Hepatitis C Therapeutic Area Data Standard User Guide v1
- QT Studies Therapeutic Area User Guide v1
- Diabetes Therapeutic Area User Guide v1.0 – Supplement for ADaM
- Tuberculosis Therapeutic Area User Guide v2.0
- Diabetic Kidney Disease Therapeutic Area User Guide v1.0
- Ebola Therapeutic Area User Guide v1.0
- Rheumatoid Arthritis Therapeutic Area User Guide v1.0
- Malaria Therapeutic Area User Guide v1.0
- Kidney Transplant Therapeutic Area User Guide v1.0
- TAUG-Influenza v1.1
- Virology Therapeutic Area User Guide v2.1
- Prostate Cancer Therapeutic Area User Guide v1.0
- Schizophrenia Therapeutic Area User Guide v1.1
- Major Depressive Disorder Therapeutic Area User Guide v1.0
- Traumatic Brain Injury Therapeutic Area User Guide v1.0
- Duchenne Muscular Dystrophy Therapeutic Area User Guide v1.0
- Vaccines Therapeutic Area User Guide v1.1
- Chronic Obstructive Pulmonary Disease Therapeutic Area User Guide v1
- Colorectal Cancer Therapeutic Area User Guide v1.0
- Huntington’s Disease Therapeutic Area User Guide v1.0
- Post Traumatic Stress Disorder Therapeutic Area User Guide v1.0
- Clostridium Difficile Associated Diarrhea Therapeutic Area User Guide v1.0
* CDISC (Clinical Data Interchange Standards Consortium)
임상 데이터 교환 표준 컨소시엄(CDISC)은 임상시험 데이터의 상호교류를 위해 표준화를 수행하는 비영리단체로 정보 시스템 상호 운용성을 활성화하여 의료 연구 및 관련 의료 분야를 개선하기 위해 개발된 조직입니다.
** C-Path (Critical Path Institute)
2005년 FDA에서 신약 개발을 보다 효율적이고 빠르게 진행하기 위해 Critical path Initiative 프로그램을 진행하였고, 이후 FDA와 비영리 공공-민간 파트너쉽 기관인 C-Path Institute가 설립되었습니다. C-Path의 목표는 새로운 치료법의 효능과 안전성을 과학적으로 평가하는데 도움이 되는 새로운 데이터의 표준, 측정 표준 및 방법 표준의 생성을 통해 신약 개발 속도를 가속화 하고 비용을 줄이는 것입니다.
3. TAUG 를 활용한 imtrial
저희 imtrial은 FDA 및 PMDA 승인을 위한 데이터의 표준 및 전주기 요구사항을 사전에 지원합니다. Metadata Repository가 CDISC Standards 및 TAUGs 기반의 Concept 으로 구성되어 임상시험이 Start to End 로 자동구현 됩니다.
Figure. Example of Concept for Height
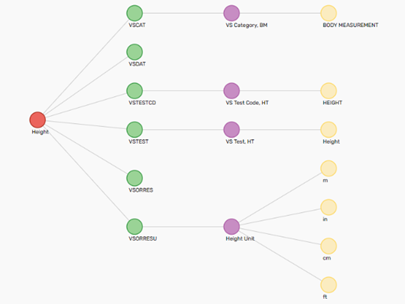
임상시험 초기 단계에 Concept 을 이용한 연구디자인 설정으로 CRF, eCRF Configuration, draft aCRF 및 Define-XML 이 자동 생성되며, DB Lock 이후 단계에는 간단한 설정으로 SDTM dataset, Define-XML 및 cSDRG의 문서 등을 확정할 수 있습니다. imtrail 에 Metadata Repository 를 구성하는 Data Standards는 FDA, PMDA Data Standard Catalog 에 따라 SDTM, Define-XML 을 제공합니다. 또한 실험실 데이터는 LOINC 코드를 생성할 수 있고, CDASH 기반의 SDTM 변환으로 cSDRG에 명확한 Legacy data conversion plan 과 report를 제공합니다.
참고. FDA and PMDA Study Data Submission Distinctions

Reference
- Study Data Technical Conformance Guide v4.7, FDA, March 2021
- FDA and PMDA Study Data Submission Distinctions, phuse, 2021

