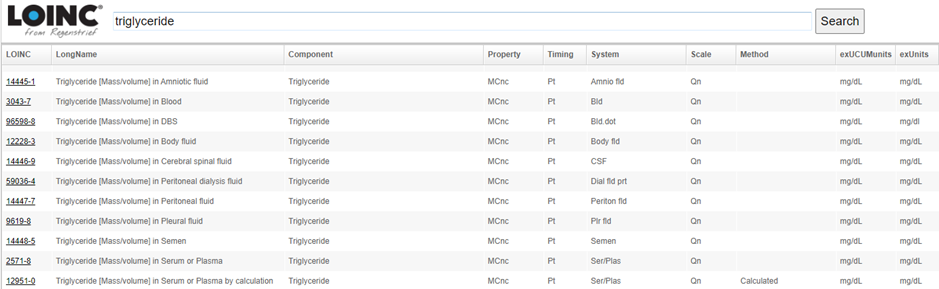
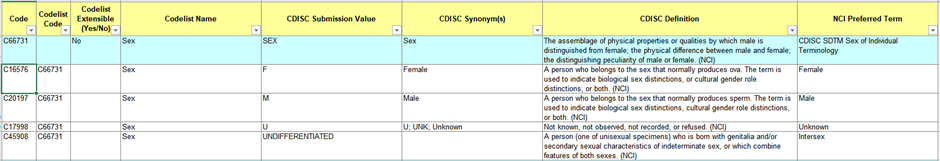
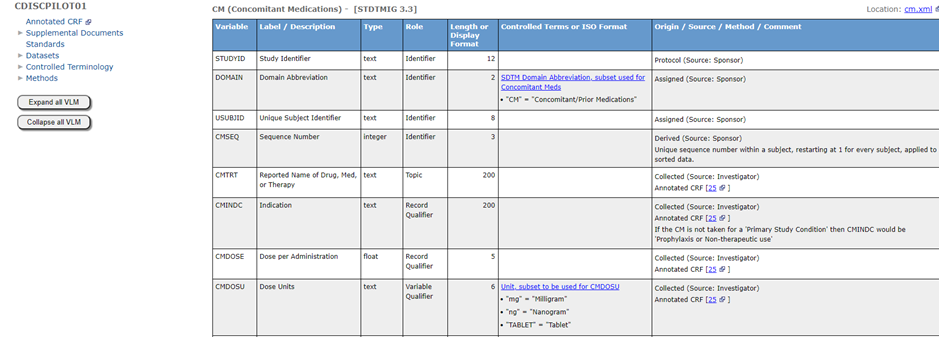
1. Study Data Standards Catalog
연구 정보, 안전성 및 유효성을 입증하는 문서 및 데이터는 규제 기관 검토 과정에서 의문이나 질문을 받지 않게 완전해야 합니다. 불완전한 제출 자료는 최종 결과에 영향이 없을 수는 있지만 변경, 추가 자료 요청으로 승인에 지연을 불러올 수 있습니다. FDA, PMDA는 IND, NDA 등 자료 제출의 완전성을 위해 Data Standards를 Catalog에 명확히 제시하고 있습니다. Data Standards Catalog 에는 사용 가능한 Data Standards 와 용어집 정보가 포함되어 있습니다. Data Standards 예로는 SDTM, ADaM, define-xml 등이 있고, 용어집 예로는 CDISC Controlled Terminology, MedDRA, WHO Drug Dictionary 등이 있습니다. 아래 링크에서 FDA, PMDA에 최신 버전의 Data Standards Catalog 문서를 다운로드 할 수 있습니다.
Table 1. FDA Data Standards Catalog v7.0
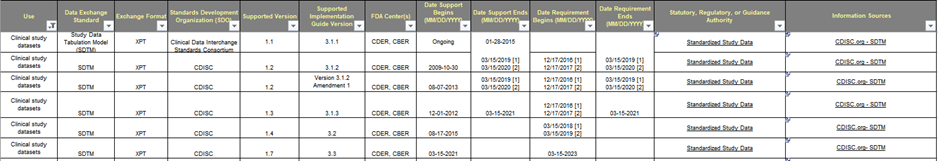
FDA 문서인 Study Data Technical Conformance Guide 에서는 IND 시점에 연구 데이터의 표준화 제출 계획을 Study Data Standardization Plan(SDSP)에 포함하고 지속적으로 업데이트 하는 것을 권고하고 있습니다. 이는 CDER, CBER, PMDA 제출 시 모두 적용되며 SDSP 문서는 Appendix 로 요청되고 있습니다. 글로벌 진출을 위한 신약이라면 개발 초기부터 Data Standards 와 용어집을 잘 파악하여 사용하는 것이 중요합니다. SDSP 양식은 다음 경로에서 SDSP 검색어로 다운 받을 수 있습니다.
- FDA : Study Data Standardization Plan
- PMDA : Attachment 8 검색하여 다운
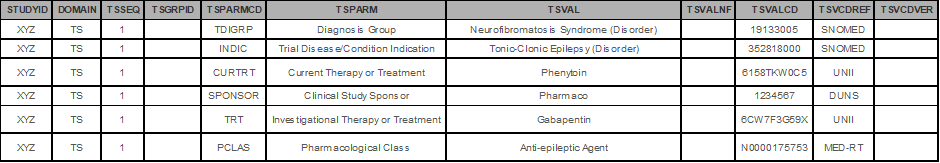
- – TRT (Investigational Therapy or Treatment)
- – CURTRT (Current Therapy or Treatment)
- – COMPTRT (Comparative Treatment Name)
다음 경로에서 검색하실 수 있습니다.
> MED-RT
임상시험용 의약품을 약학적으로 분류하고 코드화 하며 Department of Veterans Affairs/Veterans Health Administration에서 유지 관리합니다. TS Domain 에서는 PCLAS (Pharmacological Class) 매개변수에 대한 코드값을 제공할 때 사용해야합니다. MED-RT 및 아래 SNOMED-CT는 다음 경로에서 용어집 선택 후 검색하실 수 있습니다.
> SNOMED-CT
- – INDIC (Trial Disease/Condition Indication)
- – TDIGRP (Diagnosis Group)
> DUN
> LOINC