배경
1997년 임상시험 분야 표준 개발기구인 Clinical Data Inter-change Standards Consortium(CDISC)가 설립되어 임상 시험 자료를 전자 문서화하고, 이들 전자 문서의 생성/교환, 제출, 및 저장방법을 지원하기 위한 표준을 정의하였습니다.
미국에서는 2016년 10월에 CDISC 표준들 중 Controlled Terminology, SEND, SDTM, ADaM, Define-XML를 국가표준으로 채택하였고, 일본에서도 2020년 4월부터 Controlled Terminology, SDTM, ADaM, Define-XML을 전자자료 제출 표준양식을 의무화하였으며, 유럽에서는 CDISC 표준을 국가표준으로 채택하는 것을 고려 중이나 법규에 의한 강제가 아니어도 실제적으로 허가 신청의 상당수가 이미 CDISC 표준을 따르고 있습니다.
한편 국내에서는 허가 등을 위한 CDISC 형식의 자료 제출에 대한 의무규정이 없고, CDISC 표준에 대한 이해도가 낮아 CDISC 표준의 활용도가 매우 낮은 실정입니다. 또한 임상시험을 주관하는 수탁기관이나 제약회사, 심사기관 등 관련 기관들마다 서로 다른 데이터 구조와 표현을 사용하고 있어, 관련 기관들 사이에 정보를 주고받을 경우, 서로 다른 상대방의 데이터 구조와 표현에 맞추어 다시 작성 후 전달해야 하는 번거로움이 있습니다.
이에 대한 불편함을 해소하고자, 우리는 CDISC 표준의 metadata 저장소를 구축하여 연구 설계 단계에서부터 CDISC 표준 metadata를 적용시켜, 시스템 간의 전자 문서의 생성/교환이 가능하게 되고, 입력된 임상 데이터에 대하여 특별한 데이터 후처리 과정 없이 정부기관 제출이 가능한 CDISC 표준의 데이터 셋으로 자동 생성되는 시스템을 개발 중에 있습니다.
CDISC 360 Project
CDISC 360 프로젝트는 전세계적으로 e-Clinical Trial 분야 전문가들이 모여 임상시험의 시작단계에서부터 종료된 후 정부기관에 데이터가 제출되는 모든 단계에 적용된 CDISC 표준들을 유기적으로 연결하여 End-to-End 임상시험 절차 자동화를 구현하고자 2019년 4월에 시작되었습니다. 우리가 개발하려고 하는 시스템의 목적과 CDISC 360 project의 목적이 일치하다고 생각이 되어 해당 프로젝트가 시작되는 당시 참여하여, 현재도 계속 진행 중에 있습니다.

구체적으로 CDISC 360 프로젝트는 6개의 Workstream Teams으로 구성되어 다음의 3가지 Use Case가 구현될 수 있도록 시스템을 구축하고 있습니다.
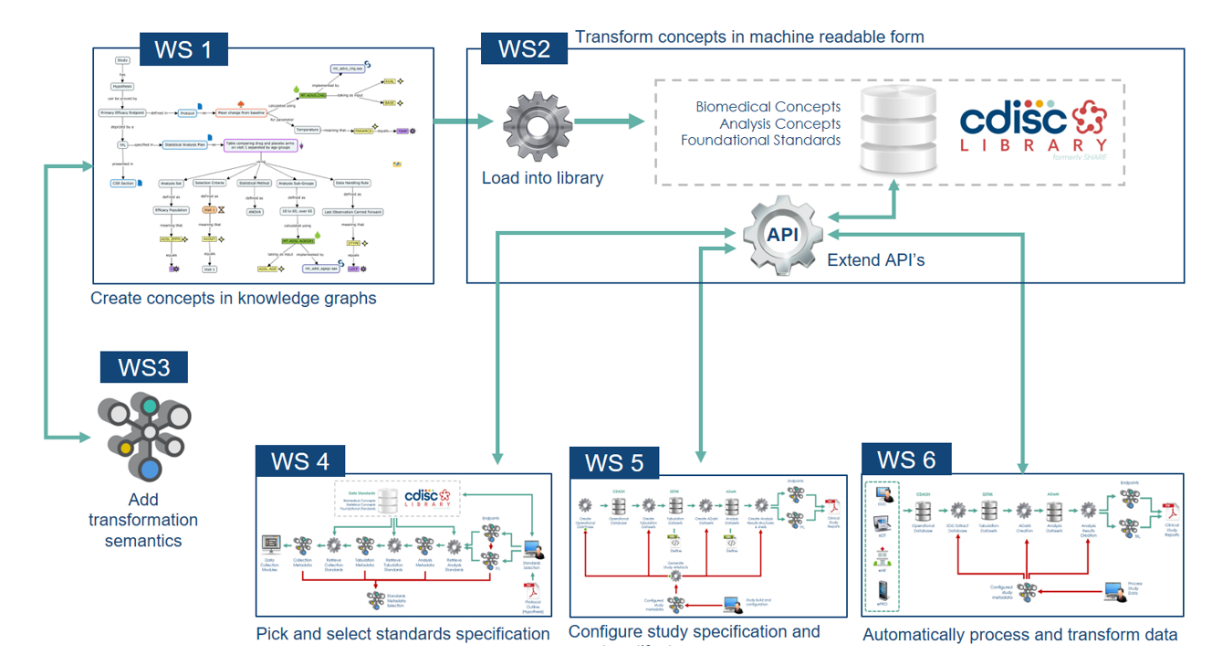
> 1. Use Case 1: End to Start specification
[Selecting standards concepts and linked metadata needed for a study]
: 연구의 주제가 설정되면, 그에 필요한 metadata들이 자동으로 연결됩니다. 예) 연구의 주제를 설명하게 되면 (예: Diabetes Type2) 해당 연구의 표준화된 Primary, Secondary endpoint(예: HbA1C 또는 Hypoglycemic episode)가 자동으로 제시되고, 그에 따른 표준화된 metadata specification 이 자동으로 선택될 수 있습니다.
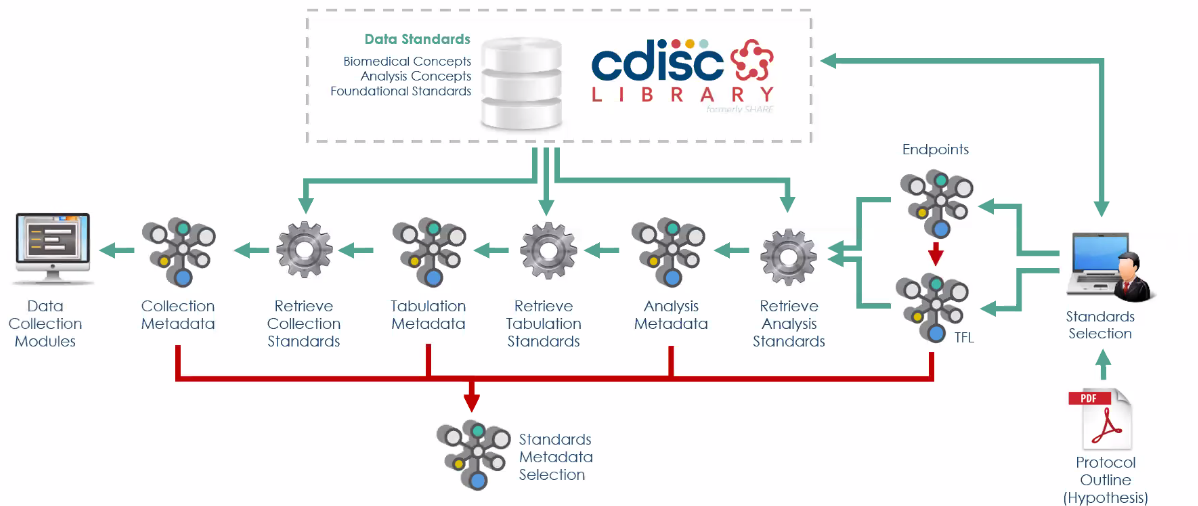
> 2. Use Case 2: Start to End Study Metadata
[Adding study design, concept configuration & generate artifacts]
: Study Design 및 Schedule of Activities (SoA) 대한 정보가 추가되면 metadata 가 자동으로 구성되고 이에 따른 CDASH database, SDTM dataset, ADaM dataset 자동으로 생성됩니다.
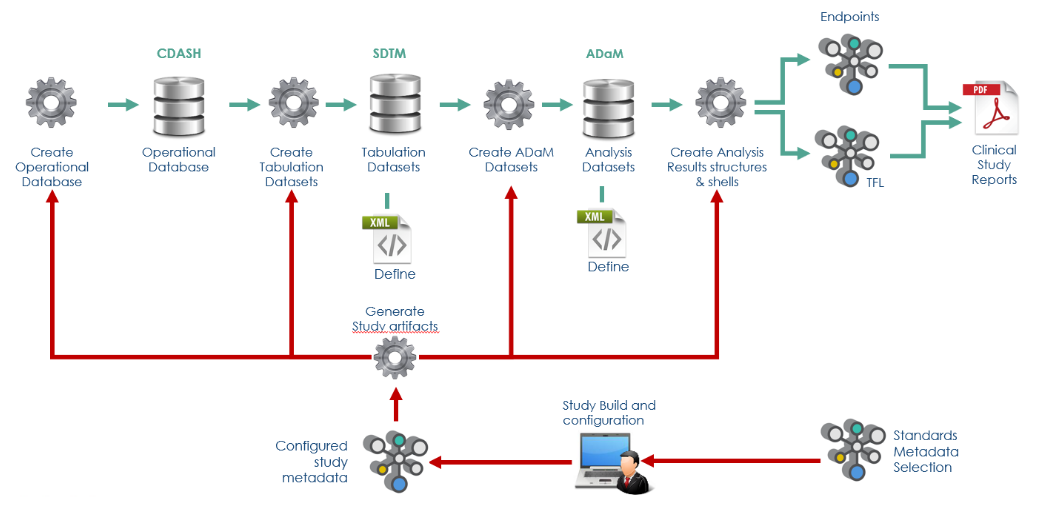
예) Study design (Visits, Arms, Epochs), Study parameters, Eligibility criteria Schedule of activities (SoA), Study workflow)를 입력하고, 원하는 CDISC standard 및 해당 버전을 선택하면, 임상 데이터가 포함되지 않은 SDTM package(aCRF, Dataset, Define.xml, Study data reviewers guide(SDRG) 및, ADaM package(Dataset, Define.xml, Analysis data reviewer guide(ADRG))가 자동 생성될 수 있습니다.
> 3. Use Case 3: Start to End Data Processing
[Automatic population of data into artifacts]
: 연구가 진행되면서 Clinical data가 입력되면 입력된 데이터가 자동으로 SDTM 또는 ADaM dataset에 배치되어 연구 결과물이 생성됩니다. 예) EDC 혹은 ePRO 등을 통해 임상데이터가 입력되면서 연구가 진행되면 중간 보고를 위한 SDTM 및 ADaM dataset 이 자동으로 생성될 수 있습니다.
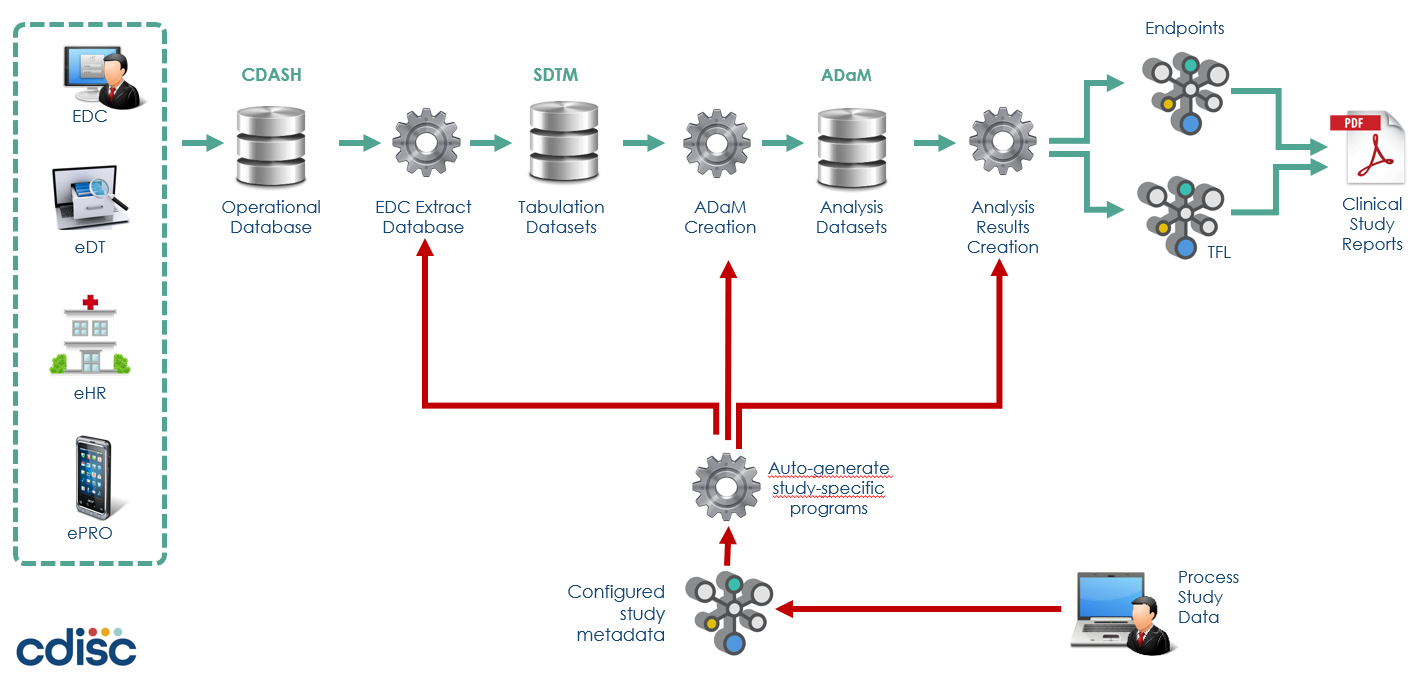
imtrial 시스템
임상시험 전 과정을 자동화해보자 하는 목적으로 시작된 시스템 개발이 이제 곧 1차 범위(PRM을 이용한 Study setup 부터 SDTM 자동 생성)까지 완료되어 시스템 오픈을 앞두고 있습니다. 즉, 연구를 계획하는 단계에서 SDTM package가 생성되어 연구가 진행되면서 clinical data가 입력되면 해당 데이터가 자동으로 SDTM dataset에 배치되어 결과물이 생성되는 imtrial 시스템의 프로세스는 CDISC 360 프로젝트가 구현하려는 프로세스와 동일합니다.
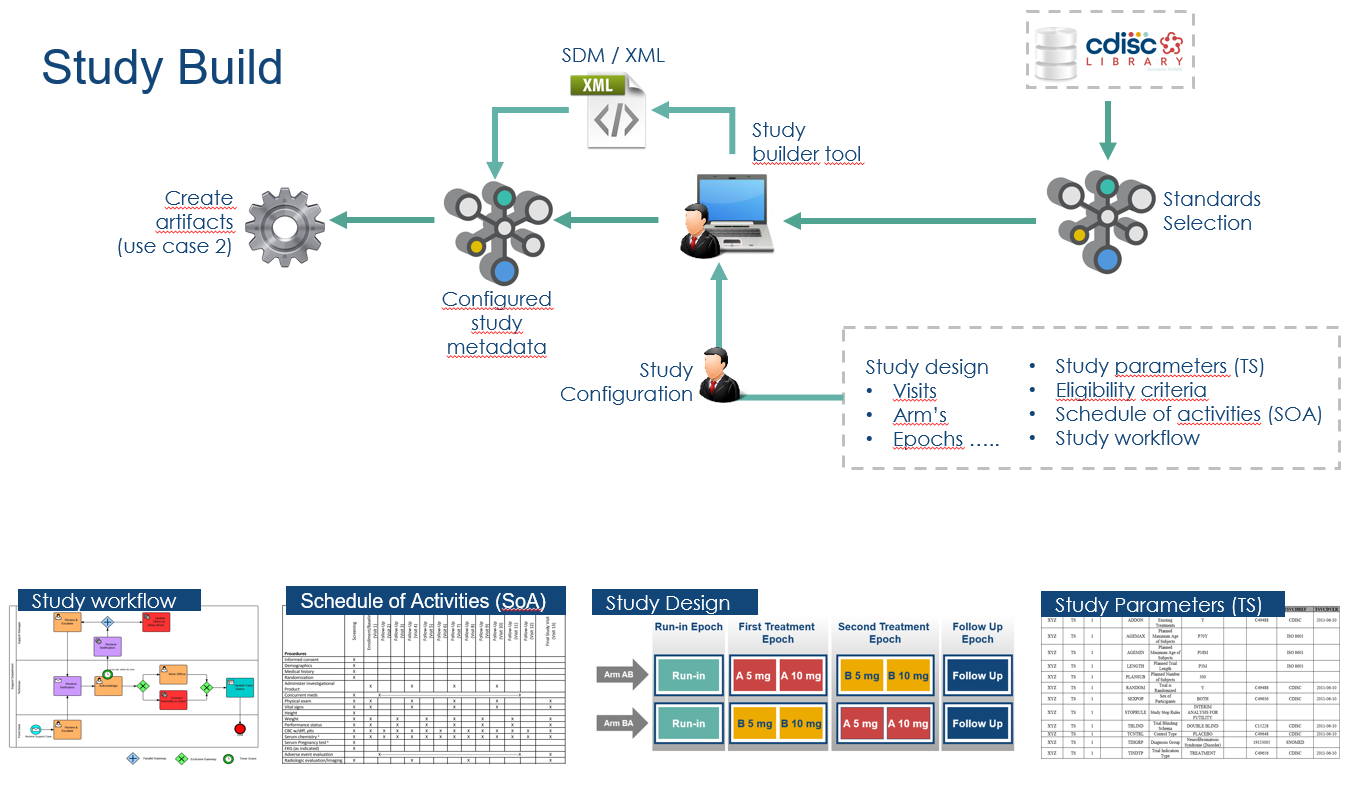
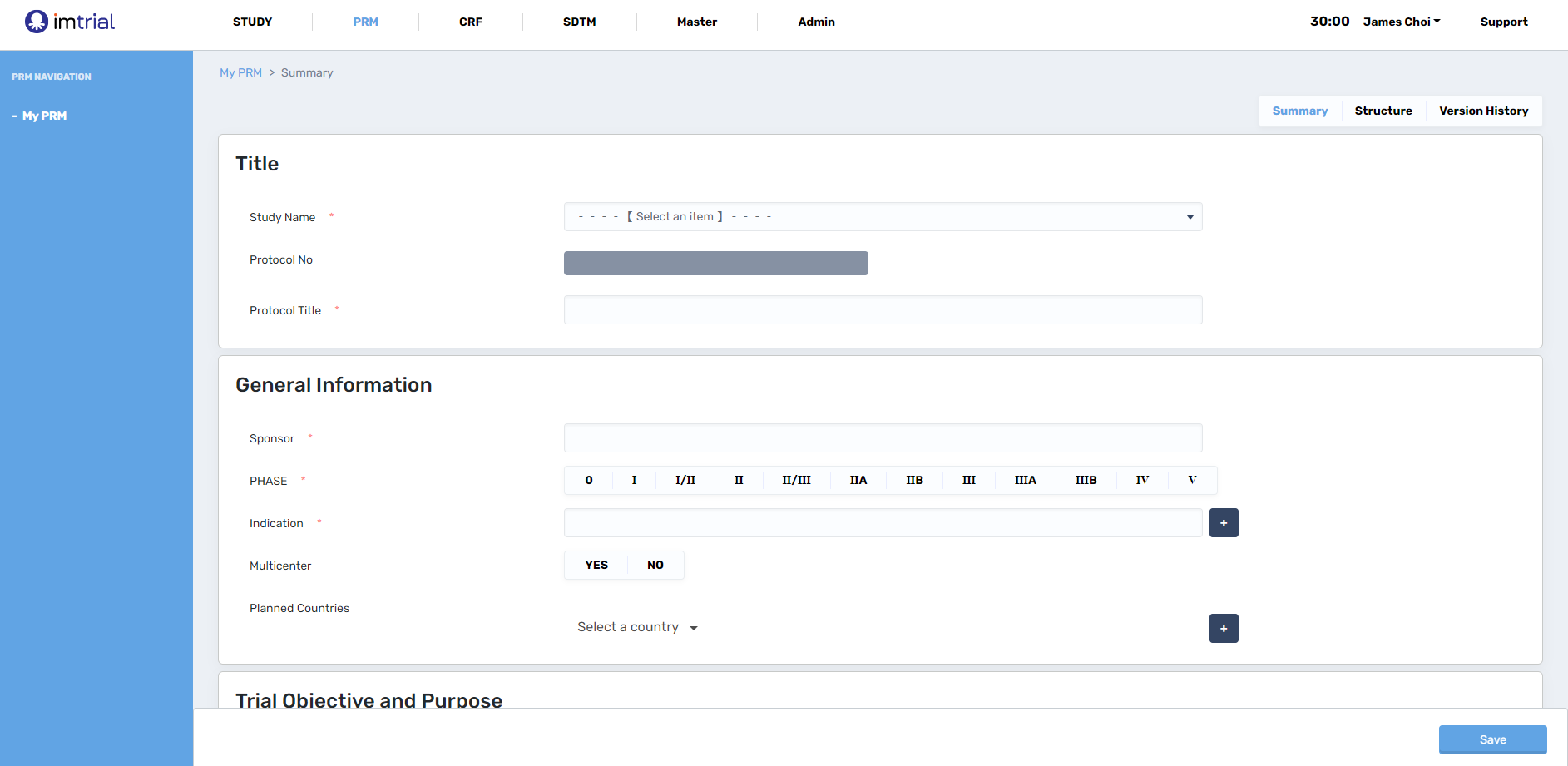
> 1. STUDY & PRM
CDISC의 표준 중에 하나인 PRM(Protocol Representation Model)의 구조를 활용하여 연구의 디자인의 주요 사항(Arms, Epochs, Visits, Activities 등)들을 MDR(Metadata Repository)에 저장된 metadata를 활용하여 입력하게 되면 SoA의 기본적인 테이블을 생성할 수 있습니다. 이후 해당 visit 별 이루어지는 activities 들을 선택하여 SoA를 완성할 수 있습니다.
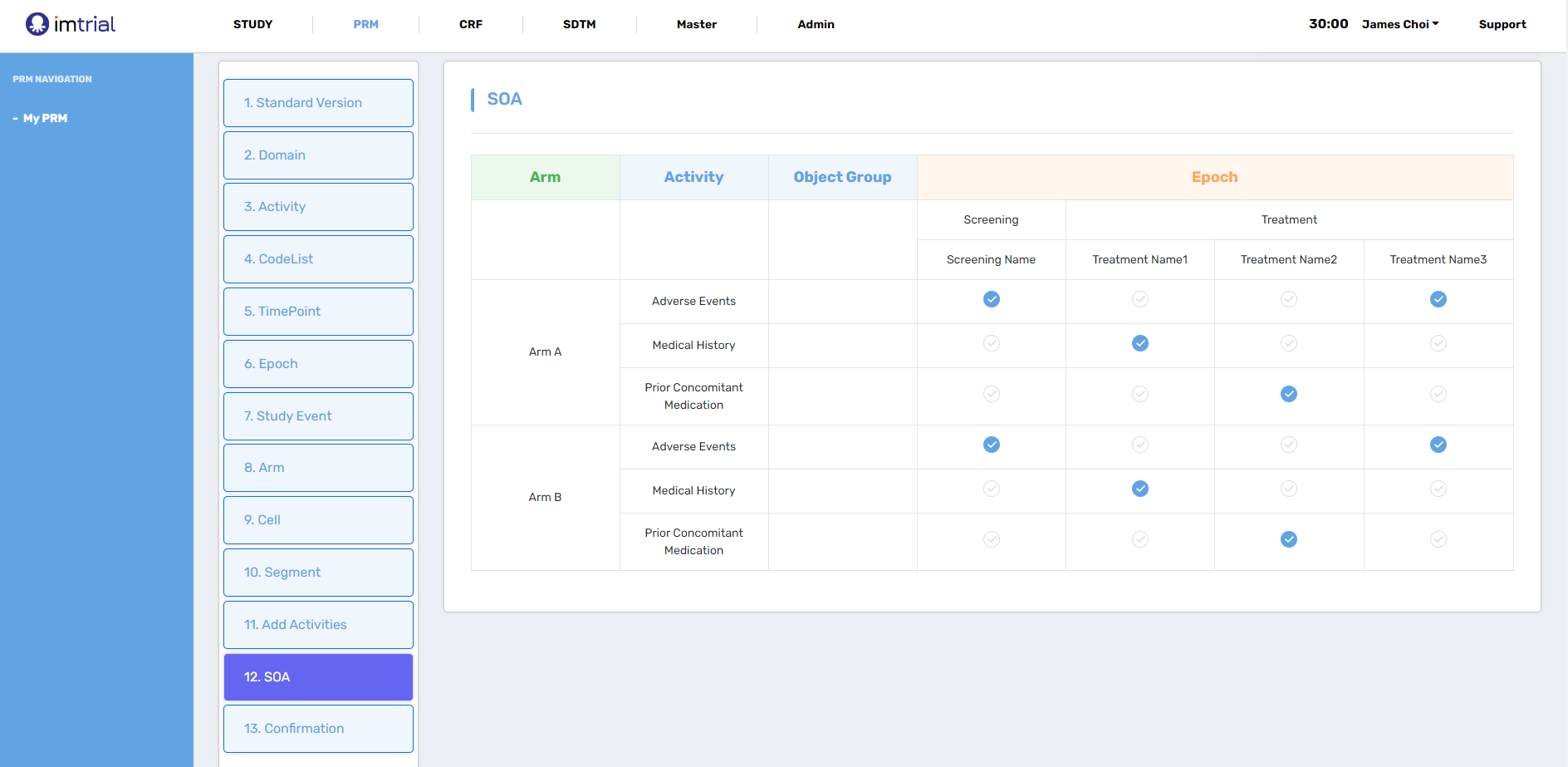
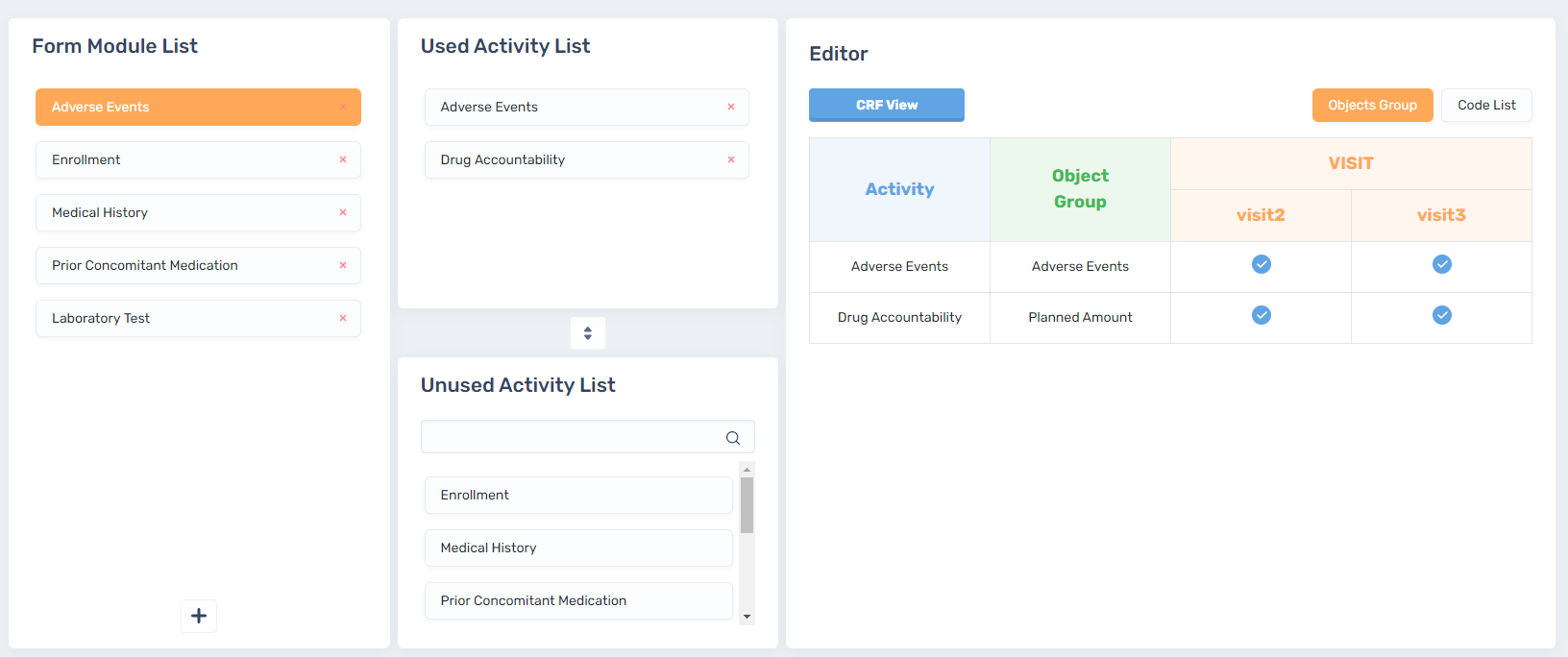
> 2. CRF & SDTM
연구 스케줄을 바탕으로 구체적으로 어떤 데이터를 수집할지를 MDR 내 저장된 데이터를 이용하여 CRF를 구성하게 되면 이를 바탕으로 자동으로 SDTM package(aCRF, SDTM dataset, Define.xml, SDRG)가 구성될 수 있습니다.
결론
C&R Research 임상 플랫폼 연구소는 현재 CDISC 표준인 Protocol Representation Model(PRM) 및 CDISC 표준을 준수한 Metadata Repository(MDR)을 이용하여 지금껏 접근하기 어려웠던 SDTM dataset 생성을 보다 쉽게 할 수 있도록 사용자가 이용하기 편한 플랫폼을 구축하여 현재 마무리 단계에 있습니다. 이후 ADaM 데이터 셋의 자동생성까지 연결하여 End-to-End Process의 자동화를 실현할 것이고, 이러한 process는 임상시험에 소요되는 시간 뿐 아니라 비용까지도 크게 절감시킬 수 있게 될 것입니다. 더 나아가 저희는 임상연구 데이터를 통합하여 데이터의 가치를 더 높일 수 있는 방법을 끊임없이 모색하고 구현할 것입니다.

