ODM (Operational Data Model) 이란?
운영 데이터 모델 (ODM)은 연구 데이터와 함께 메타 데이터, 관리 데이터, 참조 데이터 및 추적 정보의 교환 및 보관을 위한 벤더 중립적이고, 플랫폼 독립적인 형식입니다.
기존의 각 임상시험의 데이터는 서로 다른 기준으로 수집·관리되기 때문에 데이터베이스를 이동하거나 연계 작업 시 데이터 변환 작업을 다시 해야 하는 번거로움이 있고 변환 과정에서 품질 문제가 발생할 수 있습니다.
ODM 을 활용하면 데이터 및 메타 데이터의 보관 및 교환을 용이하게 하고, 규제 준수 과정이 투명해지기 때문에 Medidata, PAREXEL 등 많은 Global 업체의 EDC (Electronic Data Capture) 도구에서 CRF 내용을 표현하기 위한 언어로 선택하고 있습니다.
ODM 은 Define, SDM, Dataset, CTR 과 CT 등 CDISC 의 다른 표준들을 포함하고 외부와 연결되도록 범위를 확장하고 있습니다. ODM 은 SDM 과 결합하여 CRF 및 eCRF를 자동화할 수 있고, CTR 과 결합하여 clinicaltrials.gov 에 연구 등록 및 진행 보고를 자동화할 수 있습니다. 수집 데이터는 ODM 형식으로 교환 및 보관되며 변환 정보에 의해 Define, Dataset 이 자동 생성됩니다. 그리고 CDISC 의 PRM, CDASH, SDTM, ADaM 표준으로 업무 절차의 표준화가 가능하며, Library를 통해 재사용 가능하여 업무 효율성을 높일 수 있습니다.
ODM 활용과 구현
임상 데이터는 신약의 효과와 부작용을 검증하는 자료이기에 절대적인 정확성과 신뢰성을 요구합니다. 따라서 임상 데이터를 저장하고 교환하는 시스템을 개발함에 있어서 중요한 도전 과제는 아래 3가지 입니다.
- 복잡한 데이터 구조와 데이터 관계
- 대량 데이터
- 장기 보존 데이터의 일관성
ODM은 이러한 임상 데이터 관리 시스템을 개발함에 있어 핵심적인 역할을 합니다.
- 복잡한 데이터 구조와 데이터 관계의 규칙을 표준으로 만들어 서로 다른 기관과 시스템 사이의 데이터 교환 과정이 혼선이 없게 일관성을 부여합니다.
- ODM 표준에 정해진 규칙에 따라 저장하므로 대량의 임상 데이터의 저장이 용이합니다.
- ODM 표준의 큰 틀은 바뀌지 않으며, 버전 업데이트를 통해 새로운 규칙들을 추가 부여할 수 있으므로 장기간 ODM 표준으로 데이터를 관리해도 데이터가 오래되어 현재 규칙과 기준에 맞지 않아 폐기하거나 재가공을 해야 하는 등의 문제가 발생하지 않습니다.
imtrial 은 기존 임상시험 솔루션에 나타나는 데이터 변환 작업 과정 중 품질 및 신뢰성 저하와 데이터 훼손 문제를 해결하기 위해 ODM의 구조와 형식을 훼손하지 않고 원형 그대로 Database에 저장하도록 처리하였습니다.
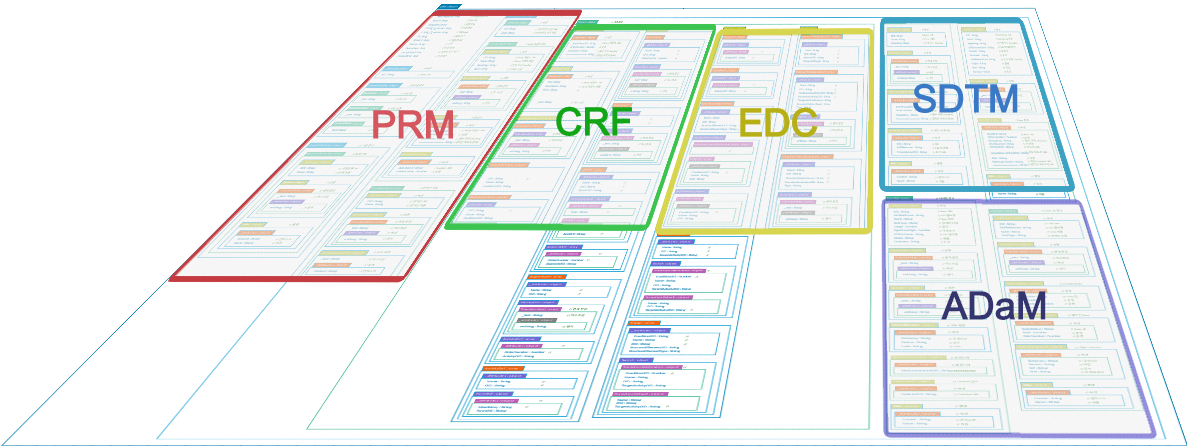
ODM에 최적화된 ODM Database를 구축하여 계획 > 수집 > 집계 > 분석 (PRM > CRF, EDC > SDTM > ADaM) 으로 연결되는 데이터 교환 과정이 한 곳에서 이루어져서 데이터 무결성과 안정성 확보가 가능해 졌으며 임상 데이터의 입출력을 간편하게 진행할 수 있기 때문에 사용과 관리에 있어서 시간과 비용을 절감할 수 있게 되었습니다.
ODM 한계와 우리의 방향
ODM을 개발한 CDISC (Clinical Data Interchange Standards Consortium) 는 데이터의 중복이나 손실 및 오류 등이 원인이 돼 발생하는 비효율 문제를 해결하기 위해 국제 전자자료 표준을 정의하고 모든 기준을 통과한 솔루션을 대상으로 인증제도를 실시하고 있습니다.
우리나라에서 사용하고 있는 EDC 중, Medidata 를 제외하면 대부분 ODM 을 완벽히 준수하지 않습니다. (import/ export 가능 여부 기준)
이 경우 완전한 데이터의 추적이 이루어지기 어렵기 때문에 신뢰성에 문제가 생길 수 있지만 word, excel, PDF 와 같은 전자 문서를 기반으로 이루어지는 전통적인 임상시험 절차에 따라 진행될 수 있기 때문에 분명한 효율성을 입증하여 이를 개선해 나가야 합니다.
imtrial 은 이 효율성을 지속적으로 입증하고 개선해 나아가야 하며, CDISC 를 포함한 국제 표준 인증들을 획득하여 신뢰도를 높여갈 예정입니다.

