배경
TransCelerate은 임상시험 계획서, 통계분석 계획서 등 모든 임상시험 문서를 표준화 및 디지털화하고 있습니다.
디지털 임상시험계획서가 CRF 등 다음 단계 작업을 위한 시스템으로 전달되어 프로세스 자동화를 가능하게 해 줍니다.
우리는 사례 조사와 위 단체 활동에 참여하고 있으며 방법론을 공유하고자 합니다.
SDTM 및 ADaM 확장: Biomedical concept은 CDASH 기반으로 수집 데이터 타입, CRF 질문 및 SDTM 변환 정보를 내포하고 있고, controlled terminology, SDTM 및 ADaM 변환을 위한 추가 정보(Derivation and mapping metadata)를 연결할 수 있어 CRF에서 ADaM까지 변환(transformation) 및 추적(traceability)를 보장합니다.
그림1. Biomedical concept
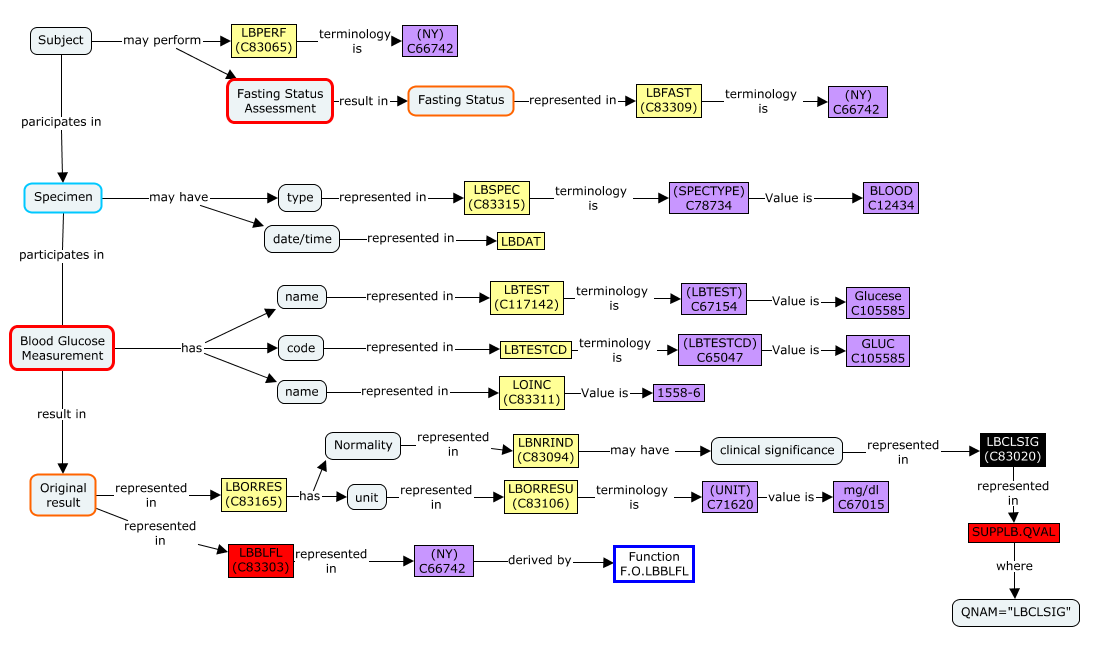
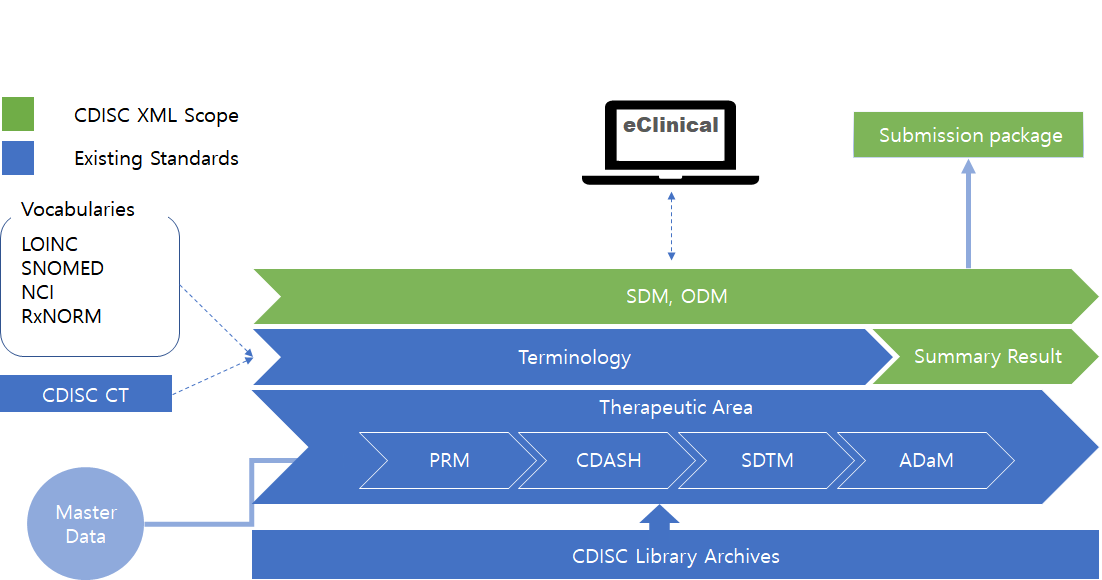
자동화: 프로토콜 디자인을 위한 PRM에 study design, 수집활동 스케쥴(Schedule of Activities)을 설정하면 biomedical concept과 연결되어 CRF가 간단한 설정으로 생성됩니다. 설정한 과제의 모든 데이터는 ODM-XML으로 생성되어 다양한 eClinical과 연동할 수 있습니다. 예를 들어 ODM import 가능한 vendor와 CRF 정보를 연동하여 EDC를 자동 생성할 수 있습니다. 또한 EDC에서 수집된 데이터는 biomedical concept 및 derivation and mapping metadata의 연결된 정보를 통해 SDTM, ADaM package를 자동 생성할 수 있습니다 (그림 2. 참고).
그림2. Executable and traceable automation process
임상시험 절차 자동화를 위한 우리의 노력
현재 우리는 CDISC 360 프로젝트에 참여하고 있으며 임상시험 절차를 End to End로 자동화하는 시스템을 개발하고 있습니다. 올해 연구 디자인에서 SDTM까지 상용화하고, 이후 ADaM 및 데이터 모니터링 등을 확장할 계획입니다. 이를 통해 치료영역 별 표준과 실제 프로토콜 사이의 갭을 줄일 수 있는 MDR을 구성하고, ODM-XML import 되는 vendor의 eClinical과 연동을 최대화하여 모든 고객이 불편함 없이 사용할 수 있도록 할 것입니다. 영어 기반 국제 표준을 한글 지원 및 자동화를 통해 쉽게 사용할 수 있게 하고, 연구목적 및 endpoint 설정으로 최적의 standard template를 제공하여 신약개발 기간을 줄이는데 이바지하고자 합니다.

