1. 제 8회 C&R Research Symposium
C&R Research 는 지난 6월 30일 서울 서초구 양재동 EL 타워에서 제 8회 씨엔알리서치 심포지엄을 개최하였습니다. 이번 심포지엄은 ‘글로벌 임상시험 전략’ 을 주제로 1부 글로벌 임상시험 환경 및 수행 전략과 2부 글로벌 임상시험의 실제 수행으로 구성되었고 국내외 최고 임상시험 전문가들이 연자로 참여해 다양한 발표가 진행되었습니다.
그리고 이곳에서 전시 부스를 열어 imtrial 서비스 오픈 후 처음으로 제품을 소개하고 시연을 진행하였습니다.

2. imtrial 전시 부스 운영
imtrial 전시 부스는 제품 설명을 위한 홍보 부스와 모니터로 프로그램을 직접 설명하는 시연 부스로 나누어 진행하였습니다.
1) imtrial 홍보 부스
imtrial 에 대해 다시 소개를 드려보자면, 일반적으로 임상연구를 진행하다 보면 시간도 오래 걸리고 이용해야 하는 프로그램도 분산되다 보니 효율적이지 못한 부분이 있다는 문제가 발생합니다.
imtrial 은 이를 개선하기 위한 새로운 방법으로 임상시험을 지원할 수 있는 플랫폼입니다.
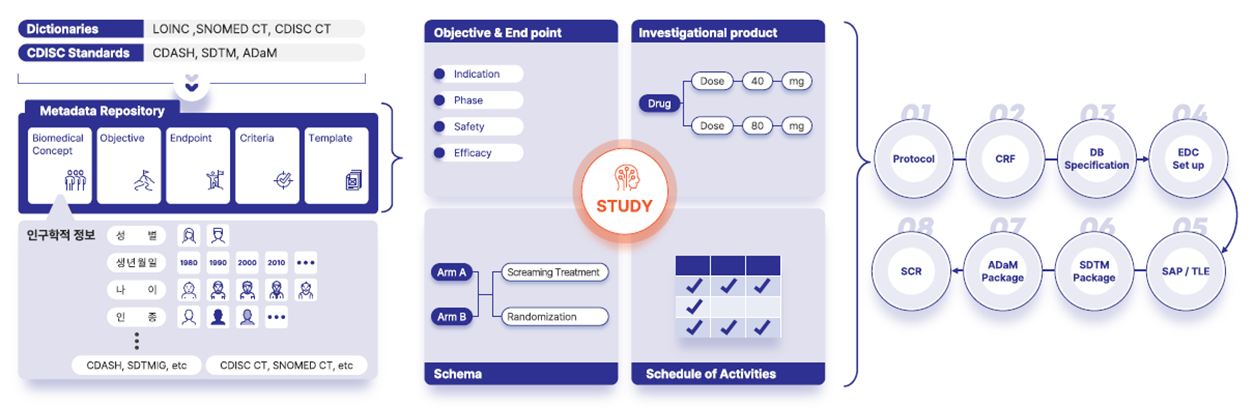
예를 들어 성별, 생년월일, 나이, 인종 등 인구학적 정보를 비롯한 모든 수집 항목들은 Concept 이라는 개념에 담아 국제표준 가이드를 기준으로 MDR (Metadata Repository) 에 저장되어 있습니다. 그래서 imtrial 서비스를 이용한다면 어떤 치료 영역이든 클릭을 통해서 계획서 상의 스터디를 구현하고 CRF 를 생성할 수 있으며 EDC 연동을 통해 설정을 자동화하고 수집된 데이터를 가지고 올 수 있습니다.
또한 FDA 의 국제 승인을 받기 위해 필요한 제출 자료까지 제공받을 수 있는 프로세스가 마련되어 있기 때문에 시간이나 비용 등을 절약할 수 있다는 장점이 있습니다.
그리고 연구자 입장에서도 연구에 더 집중할 수 있기 때문에 보다 연구결과의 품질을 높일 수 있다는 장점을 소개해 드렸습니다.
2) imtrial 시연 부스 운영
imtrial 의 실제 화면을 보여 드리기 위해 건강한 대상자 TA map 을 이용하여 미리 과제를 생성해 두었습니다.
임상시험 산업의 개인적인 이해도와 상관없이 많은 사람들이 쉽게 이해할 수 있도록, 시연 과제의 시나리오는 다음과 같이 임상 시험에서 공통적으로 진행되는 내용으로 설계하였습니다.
– 일정 : Screening, Treatment (-1 Day, 1Day, 2Day, 3Day, 4 Day), PSV
– 수집항목 : 인구학적 정보, 활력 징후, 신체 검진, 심전도 검사, 실험실 검사, IP 투여, 약동학 채혈, 이상 반응, 과거 병력, 이전/병용 약물, 증례 결론 등
시연에서는 다음의 순서로 imtrial 의 기능을 설명하였습니다.
첫 번째로, Design 메뉴에서는
– 연구 프로토콜의 연구 목적, 평가 변수, 의약품 정보, 연구 스키마, 선정/제외 기준과 같은 연구의 개괄적인 정보를 입력하고, 방문 일정과 수집 항목을 설정할 수 있습니다.
– 각 수집 항목은 imtrial MDR 에 저장되어 있는 목록에서 이번 연구에서 사용할 항목을 선택할 수 있습니다.
– CRF set up 을 통해 eCRF 에 보이는 질문, 응답 값, 값의 형식 등 수집 항목의 개별 설정을 할 수 있습니다.
– 설정을 마친 디자인의 blank CRF 뿐 아니라 Annotated CRF 를 다운로드 받을 수 있고, 프로토콜 변경 사항에 따른 CRF 변경 대비표도 버전 별로 확인할 수 있습니다.
두 번째로, EDC 메뉴에서는
– imtrial 은 EDC 솔루션과 연동이 가능하여, 앞에서 설정한 eCRF 가 EDC 솔루션에서 나오는 모습을 미리 확인할 수 있습니다.
– Build 버튼을 누르면 연동된 EDC 솔루션으로 CRF 가 전송되어 설정을 자동화 할 수 있고, EDC 를 통해 Clinical Data 를 수집할 수 있습니다
세 번째, SDTM 메뉴입니다.
– Clinical Data 에서는 EDC 를 통해 수집한 데이터를 imtrial 로 불러올 수 있습니다.
– Mapping 기능을 통해 Clinical Data 가 규제 기관 제출을 위한 SDTM DB 로 변환되는 것을 확인할 수 있고, Define-XML 도 확인할 수 있습니다.
(imtrial MDR 에는 CDISC 모델이 저장되어 있기 때문에 연구 설계와 함께 제출을 위한 mapping 도 빠른 시간 안에 가능합니다.)
– SDTM Package 에서는 앞에서 확인한 SDTM DB, aCRF, Define-XML, cSDRG 를 한 번에 다운받을 수 있습니다.
이렇게 imtrial을 사용하면 임상 시험 설계부터 수집과 제출까지 전 과정이 쉽고 빨라짐을 시연을 통해 보여드렸습니다.
3. 후기
심포지엄 부스 행사를 위한 담당자로 선택(?) 되어, 시연 과제 시나리오 구성과 설계를 머리를 맞대어 함께 준비하였습니다. 시나리오 구현을 위해 imtrial의 모든 기능을 처음부터 끝까지 사용해보고, 고객에게 설명할 스크립트를 정리하면서 우리가 만든 플랫폼의 가능성을 다시 한번 확인하게 되었습니다.
부스 현장에서는 imtrial 에 먼저 관심 가져주시고 시연 후 이것 저것 질문해주시는 분들이 여럿 계셨지만, 생각보다 우리의 존재가 많이 알려지지 않았다고 느껴졌습니다. 실제로, “이걸 C&R Research 에서 만들었다구요?” 라고 물어보시는 분도 계셔서 『imtrial 과 같은 플랫폼의 필요성은 확실히 있다』라고 생각했고, 이렇게 imtrial을 알릴 수 있는 자리가 더 필요하다는 생각이 들었습니다.



